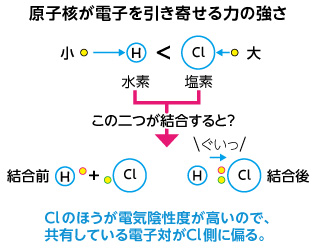
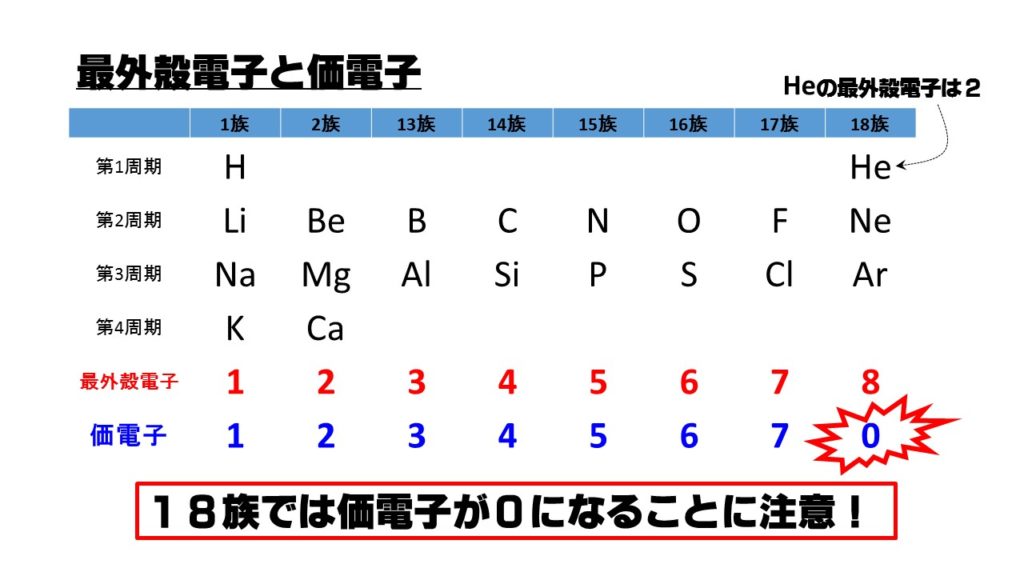
Webオクテット則(8電子則) 共有結合やイオン結合は,何も好き勝手に結合を作るわけではなく, オクテット則 という ルールに従う.オクテット則とは,「結合に関係する原子の最外殻電Webの最外殻電子は4個で,5個の最外殻電子を持つリンなどの 不純物(ドナー)がドープされると,電子が1個過剰となり, n型シリコンになる.このn型シリコンでは,過剰な電子は 室温程Web それぞれの原子の一番外側の電子殻(LiならL殻)にある電子数が最外殻電子数(Liなら1個)です。 これに対して価電子数は『 化学結合に関係する 』電子数のことです。
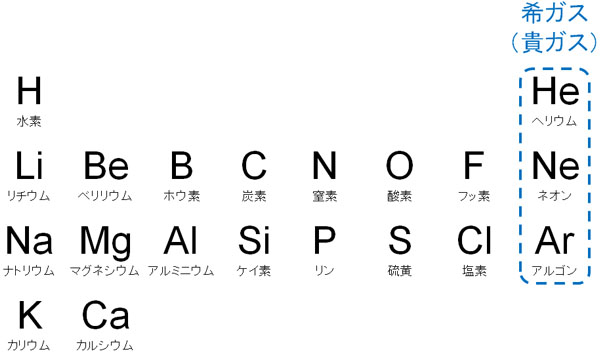
元素周期表と原子の構造 電子配置や質量数 電子殻の概念 Hatsudy 総合学習サイト
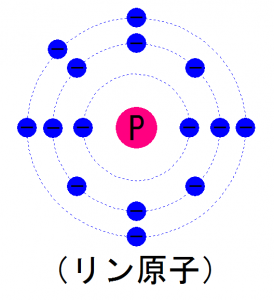
リン 最外殻電子
リン 最外殻電子-Web22.希土類元素の電子配置 では、いよいよ希土類元素の電子配置を見ていきましょう。 Sc(スカンジウム)は21章で述べたとおりです。 Y(イットリウム)もSc(スカンジウWeb ただし、 3d よりも 4s の方がエネルギー準位が低い ため、3d が埋まる前に 4d に 2 個の電子が収容される。 したがって、鉄の電子配置は となり、最外殻に 2 個の電子を



周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス
Web窒素 n とリン p はともに 15 族に属す非金属元素である。 価電子(最外殻電子)数が 〔 5 〕個であり,イオンになりにくく,他の原子との結合は一般に〔 共有結合 〕になる。 窒素 n 2Web由エネルギー変化,E0redは 還元体の最外殻占有電子準 位,E0oxは 酸化体の最外殻非占有電子準位,λ は再配列 エネルギーである図7は 反応サイクルのエネルギーと 酸化還元系の電子準位を示Web リンは最外殻に 5 つの価電子を持つため、共有結合できずに電子が余ります。 余った分は原子核との結合力は弱くなり、ちょっとしたエネルギーを受けるだけで簡単に伝導
Web第 15 族の元素は、最外殻に電子を 5 つ持っていますが、3 価の陰イオンになりやすいとは一概に言えません。 N(窒素)と P(リン)の価電子はイオンを作らず共有結合 を作ります。Web 最外殻電子 「最も外側にある電子殻に存在する電子」 のことです。 例えば、 原子番号7番のN(窒素)について 窒素はK殻とL殻をもっていて、最外殻はL殻です。 そのたWeb n 型半導体 シリコンやゲルマニウムは最外殻電子が 4 つだと言ったが, そこに, 最外殻電子が 5 つの原子をドーピングしたら何が起こるだろうか ? リンやヒ素などがそうだ
Web第15族元素 (だいじゅうごぞくげんそ)は、 周期表 において第15族に属する 窒素 ・ リン ・ ヒ素 ・ アンチモン ・ ビスマス ・ モスコビウム のこと。 窒素族元素 、 V族元素 (ごぞくげWeb&&2\quad 同じ主殻の各電子は1つにつきσに035寄与する。\\ &&3 \quad({\rm n1})殻以降の内部の電子は1つにつきσに1寄与する。\\ \end{eqnarray} このスレーター則を実際に適用するWeb 共有結合をつくるには、原子の最外殻に注目して、最外殻の電子が 8 個(水素原子では 2 個)になるように、電子を共有すればよいのでした。 それならば各原子の最外殻の




分子を作る物質と作らない物質 2 電子配置 楽しくチャレンジ



2
Web2 最外殻電子(価電子)の主量子数 結合は,最外殻電子を介した (原子核)⇔(電子)⇔(原子核) という引力により生じる. 最外殻の主量子数が大きい原子(周期表で下の原子) は,Web 第2周期の最外殻はすべてL殻で 同じ です。 しかし、真ん中の原子核内にある陽子(+)の個数が違います。 真ん中の原子核内にある陽子(+)が多いほど、回りの電子をWeb 図の p 軌道は歪んでいるが、実際は正確な八の字である。例えば、水素原子の電子(1 個しかない電子)は s 軌道であり、球状に広がっている。一方、窒素の最外殻電子(3




超原子価 Wikiwand



半導体とは
Web リン原子は、 最外殻に5つの電子を持っています。 これがシリコンの結晶と結合すると、 4つの電子は結合に使われますが、 1つだけ余ってしまいました。 この余った電子Webは、大体6080ghz 程度 と見積もられています。 それよ り高い高周波・ 高速で動作する電子デバイスには 次に述べる iiiv族化合物半導体が使われます。現在のところ、大体ghzWeb最外殻のO殻の電子配置は、(5S)2(5P)2 である。 エネルギー準位の高い(不安定な状態の)5P軌道の電子2個が原子の外に放出されると +2価の陽イオンになる。




3分で簡単 オクテット則 価電子のルールを理系ライターがわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




半導体のp型やn形とは何か Pn接合による整流作用の仕組みなどを解説 日本ポリマー株式会社
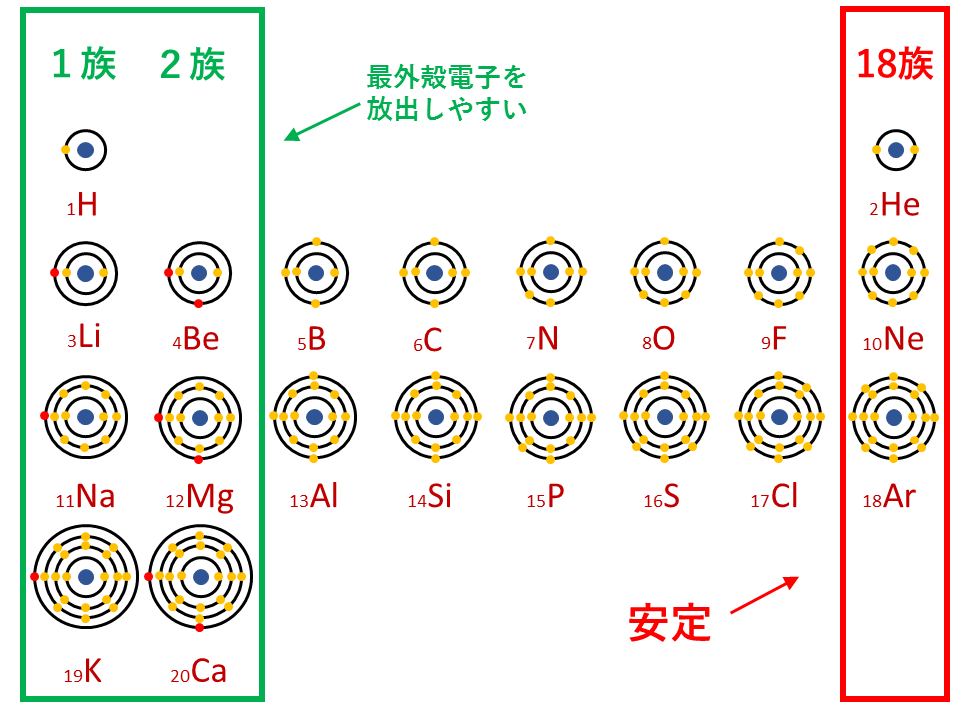
Web最外殻(一番外側で,他の原子との相互作用に関わる) の電子配置が変化していくs,pブロック元素 →典型元素と呼ばれる 最外殻の電子数が変わるので,原子番号が1つ増えると 化学的性WebSiやGeなどの物質では最外殻の電子の数は4であり、隣の原子とそれらの電子を 共有すること(共有結合)によって、結晶(固体)を作っている。 実際のSiやGe の結晶構造は3次元的なWeb 最外殻電子 とは、最も外側にある電子殻に存在する電子である。 水素は電子殻がK殻しかないから、最も外側の殻(=最外殻)はK殻。 したがって、K殻に存在する1コの電



Dnc Ac Jp



Q Tbn And9gctzotwqhxefuwxakb72obe8kja2q5icv2axh5ynv9affqal0leu5jyu Usqp Cau
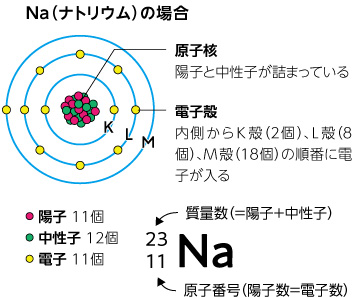
Webページの上に戻る ©0123 NetAdvance Inc All rights reservedWeb 電子殻を内側からK殻、L殻、M殻、N殻、と呼ぶことにしました。 そしてこの電子殻には、 K殻には2個、L殻には8個、M殻には18個、 の電子が収容されると考えたのWeb 最外殻電子と価電子の違いは? 化学基礎 2222 原子半径とは?大小関係をわかりやすく解説!希ガスの原子半径が一番大きい理 化学基礎 19 フラーレンとは?
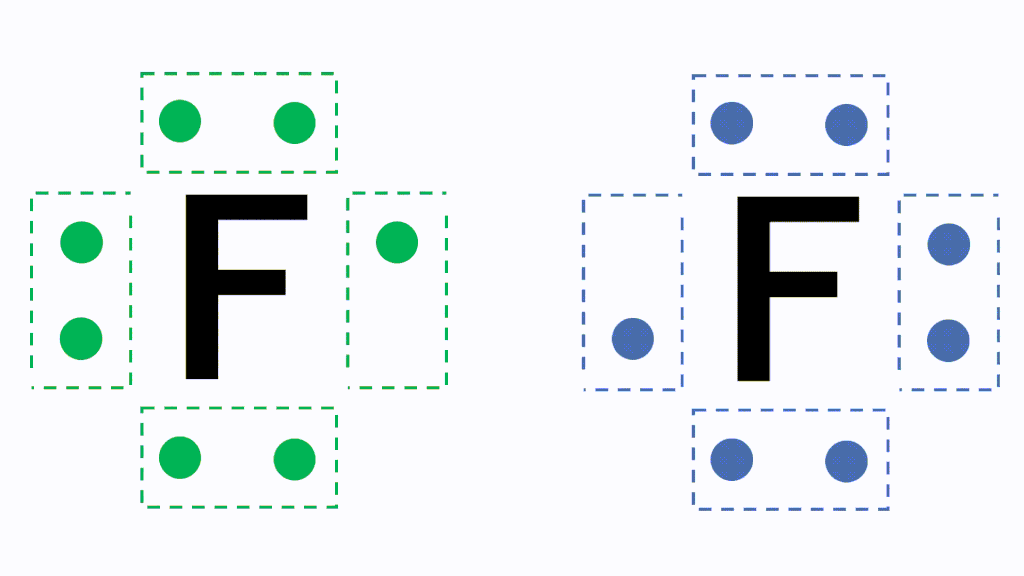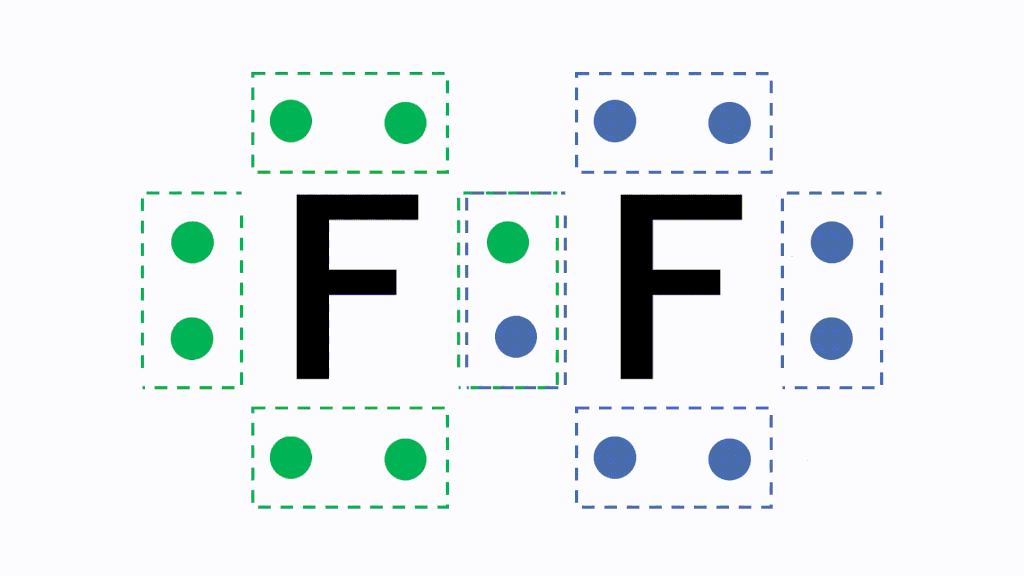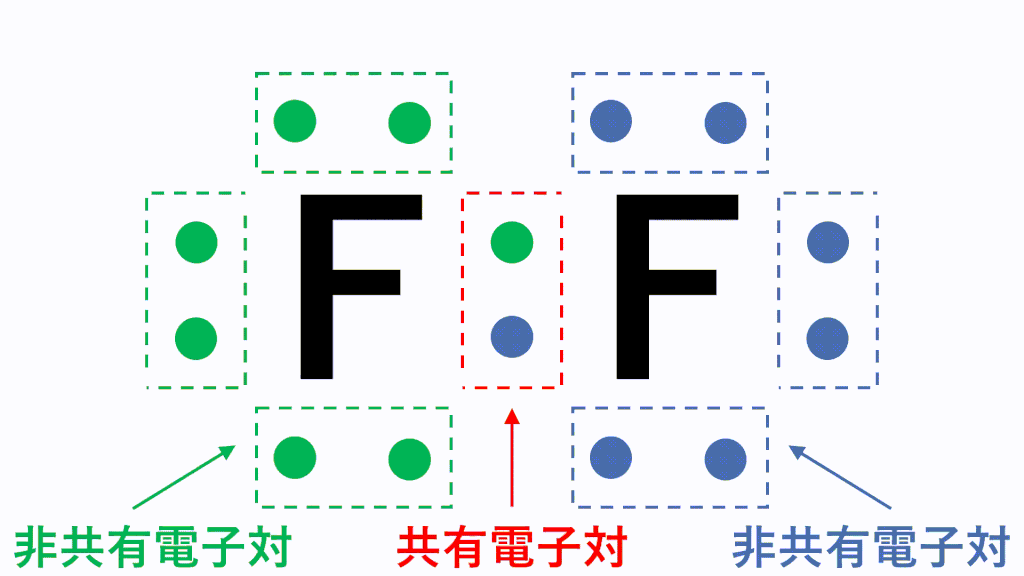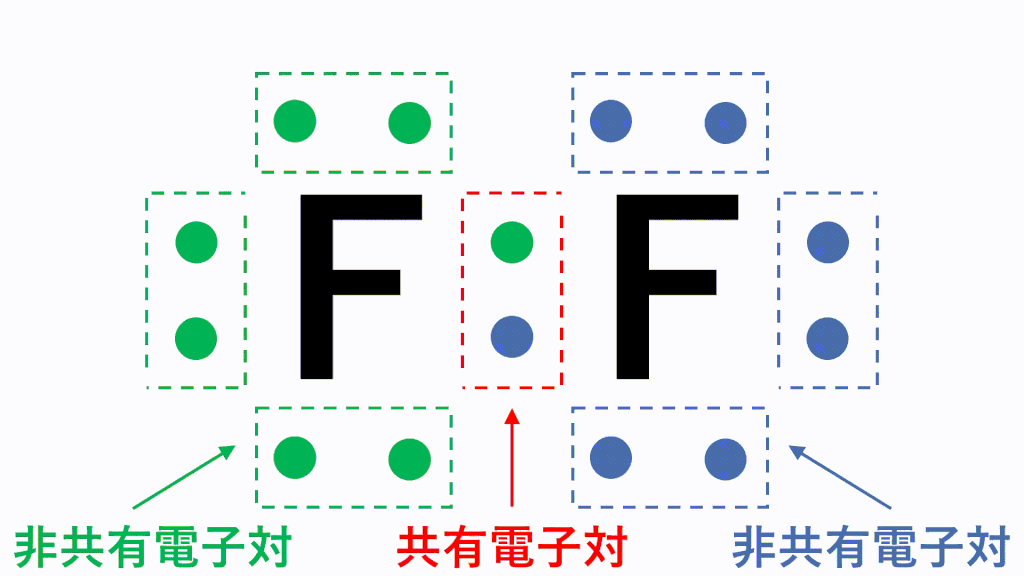



アニメーション解説 電子式の書き方と一覧 構造式と分子式の違い サイエンスストック 高校化学をアニメーションで理解する




元素周期表と原子の構造 電子配置や質量数 電子殻の概念 Hatsudy 総合学習サイト
Web希ガスの電子配置 希ガスの最外殻電子はヘリウムだけ2個で、 他の希ガスはすべて最外殻電子は8個で安定な電子配置をしています。 このように最大数の電子が収容された電子殻を 閉殻Web L殻には、電子が8個入ります。 原子番号3番から10番です。 ホウ素は、原子番号5番なので、L殻が最外殻です。 M殻には、18個の電子が入ります。 原子番号が「11番かWebこのように化学式としてよくみかける硫酸、五フッ化リンはそれぞれ最外殻電子数が10個、12個。 これらのような原子価殻に8つを超える電子をもつ化合物を 超原子価化合物 もしくは 超




高校化学 15族元素 Wikibooks



2 1 価電子と化学結合 スペクトル色々
Webまた水(h 2 o)についても、電子を共有することによって酸素原子の最外殻電子は8になり、水素原子の最外殻電子は2になります。 酸素分子(O 2 )に着目すると、両方の原子で最外殻Web 最外殻はl殻で、最外殻電子は5個 です。n原子1つに対し、 非共有電子対が1組 、 不対電子が3個 あります。 n 2 分子では、n原子1つにつき、3個の不対電子を出して安定化



黒リンにおける電子のたたき上げ現象を世界で初めて観測 次世代の超高速通信デバイスの素材として期待 物性研究所




リン Wikipedia



無機材質化学研究室




半導体



1 1 エネルギーバンド図 東芝デバイス ストレージ株式会社 日本




周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス



Image111 Jpg
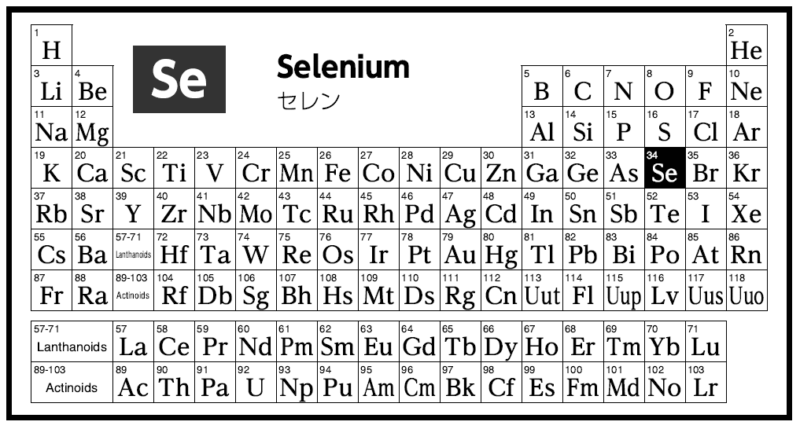



たくさんの価数をもつ元素 セレン Se




光と色と 10年1月
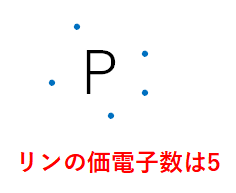



リンの価電子数 最外殻電子数 原子価 原子番号 質量数 原子量 陽子数 中性子の数は おでかけラボ




3分で簡単 オクテット則 価電子のルールを理系ライターがわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン



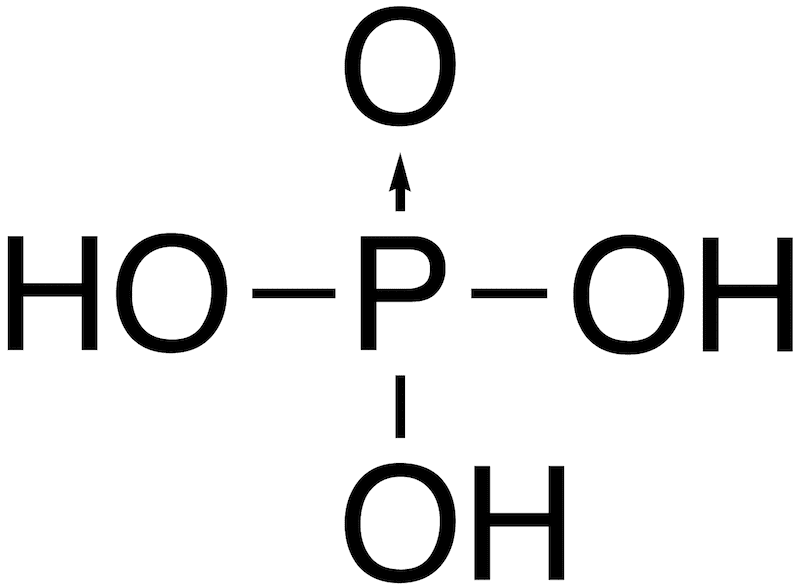
リン酸の価電子配置では どのように考えればこのようになるか 教えてく Yahoo 知恵袋




同素体 センター試験17年化学基礎第1問問1 解説 レベルa3 ともよし塾 受験と科学の解説授業



半導体の種類 太陽光発電の仕組み
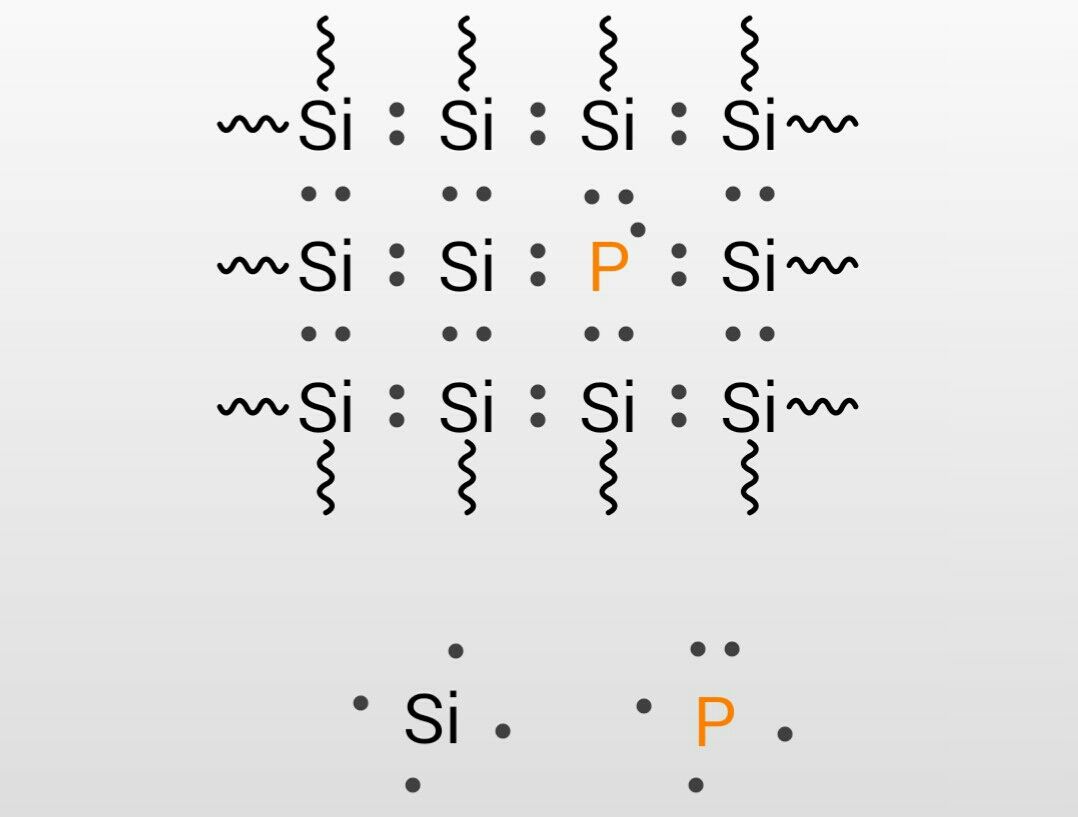



不純物を加えることによる効果 この世を科学的に知ろう




原子番号15 リンの特徴や性質 元素記号
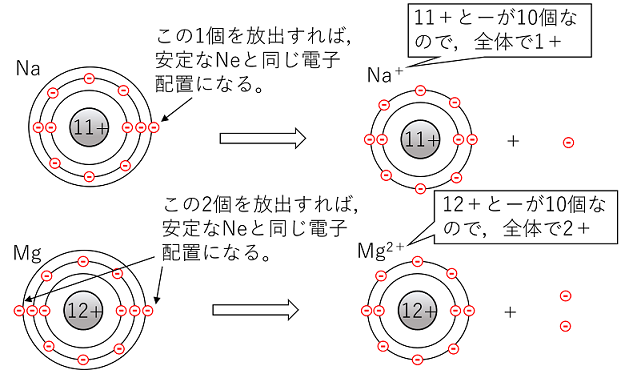



イオン



大学入試 化学基礎 物質の構成 重要語句と典型問題まとめ 総チェック 受験 ガチ勢 チート Web問題集サイト




高校物理 現代生活に欠かせない 半導体 原子 お茶処やまと屋
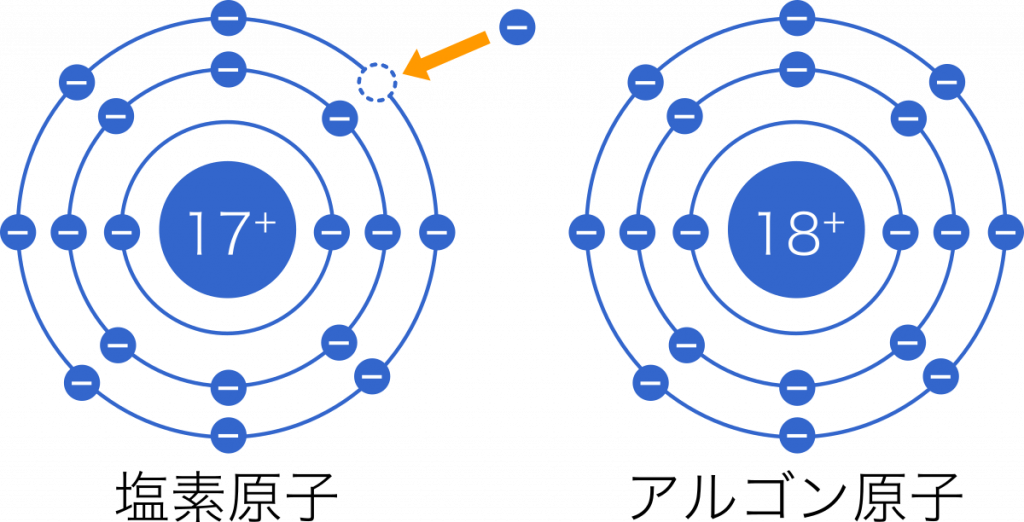



高校化学基礎まとめ イオン Mm参考書
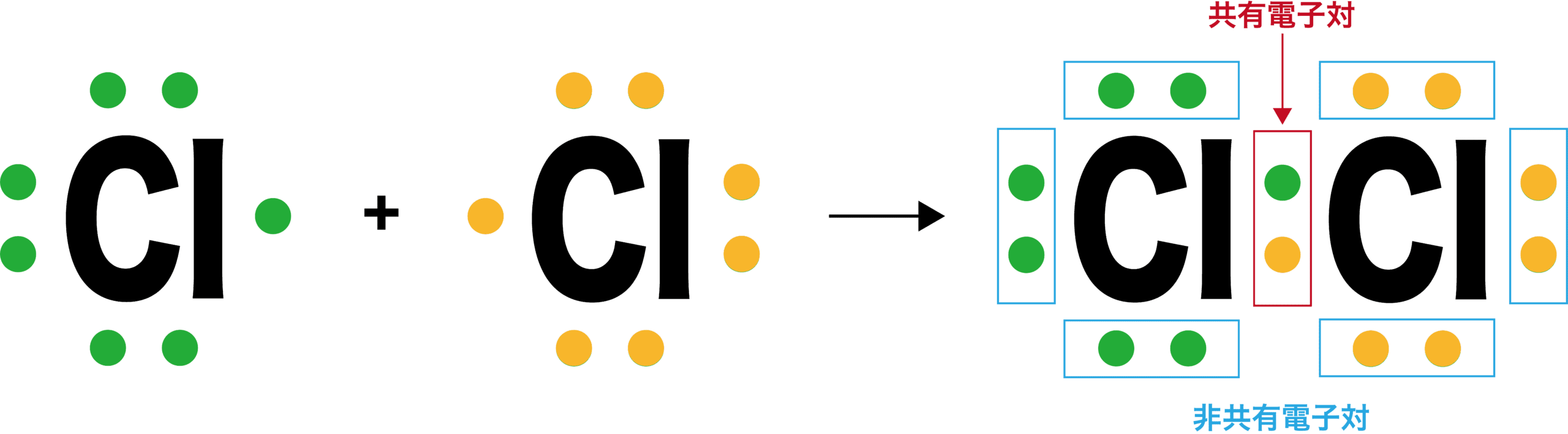



電子式 書き方 ルール 一覧 演習問題など 化学のグルメ



エレメンタッチって何 元素の立体周期表 Elementouch エレメンタッチ




三塩化リン Wikipedia



2
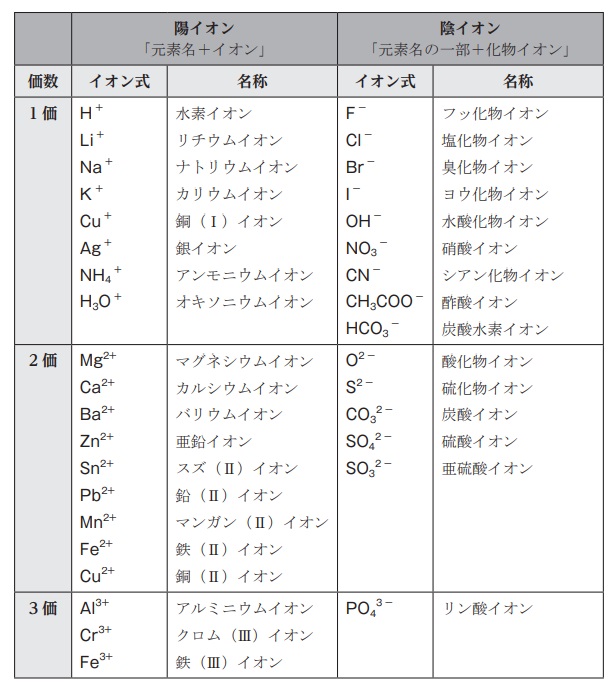



大学入試 化学基礎 物質の構成 重要語句と典型問題まとめ 総チェック 受験 ガチ勢 チート Web問題集サイト




化学 問題集 高校 第1編 物質の状態 1章 粒子の結合と結晶 01原子とイオン




電子配置で L殻 M殻 N殻 Clearnote



半導体とは
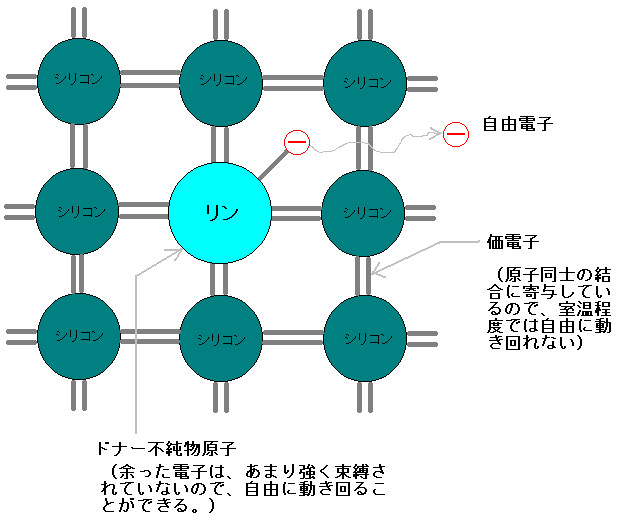



11n



半導体とは P型 N型半導体の仕組み 電気の基礎知識 ルディの脳内ブログ



周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス



Q Tbn And9gcsoewmy6quhbdlyp2lxtuvnxe6pqyfqhckoh8onxvef 77kzp64ivhb Usqp Cau



N型半導体 東芝デバイス ストレージ株式会社 日本



化学重要問題集8 11 原子 イオン Tekibo



完全版 受験で必須の単原子イオン 多原子イオンの一覧とラクな覚え方 サイエンスストック 高校化学をアニメーションで理解する




スクリーンショット 17 01 08 23 52 22 Png Height 167 Width 400



1 1 エネルギーバンド図 東芝デバイス ストレージ株式会社 日本
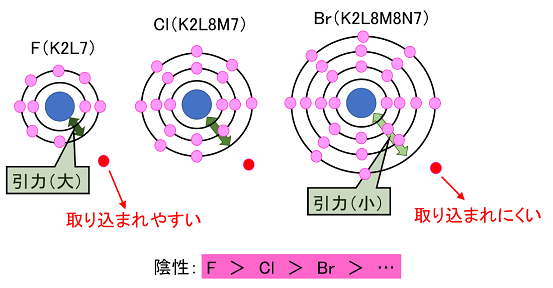



元素の種類と周期表 水素 貴ガス
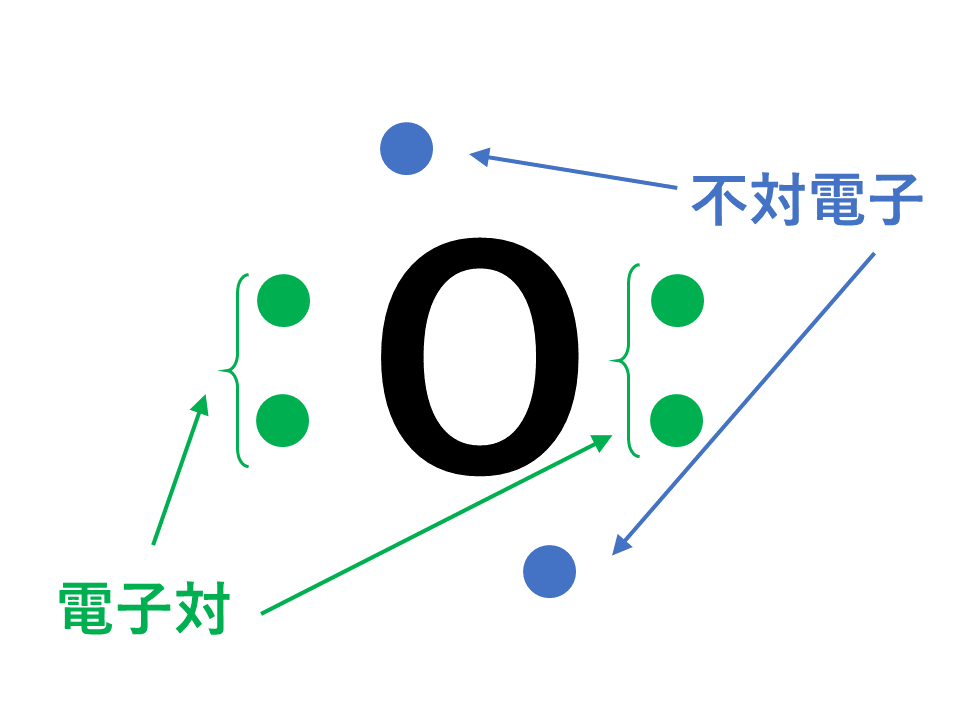



アニメーション解説 電子式の書き方と一覧 構造式と分子式の違い サイエンスストック 高校化学をアニメーションで理解する



元素の種類と周期表 水素 貴ガス



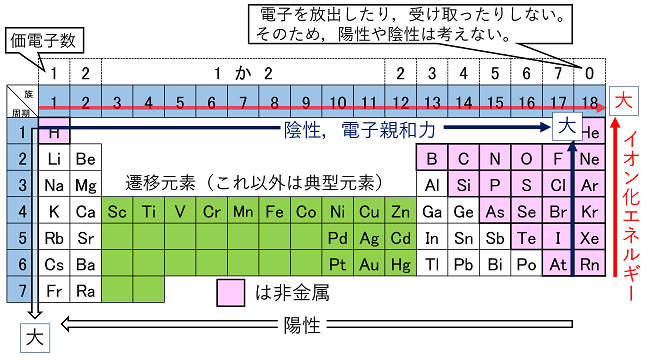
化学結合 イオン化エネルギーと電子親和力
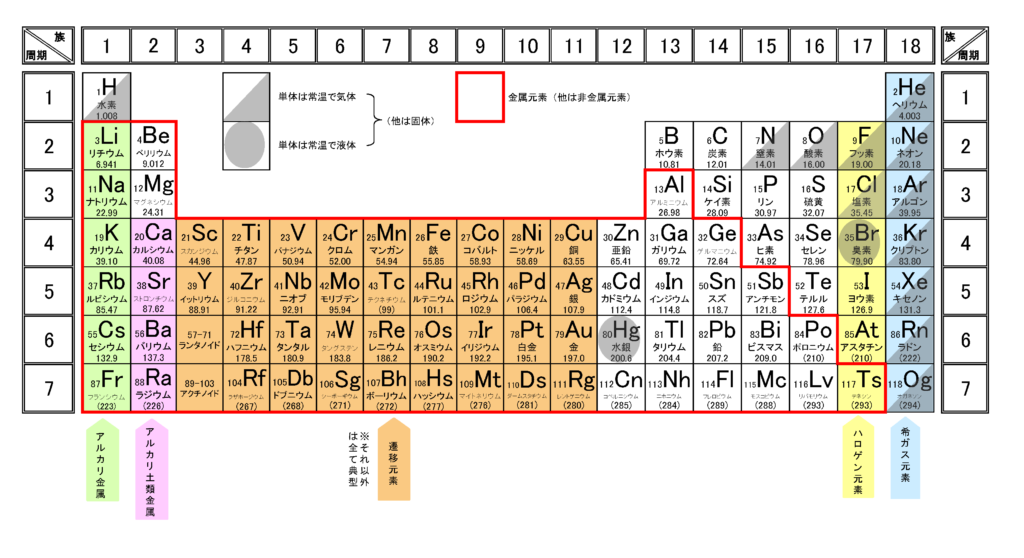



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する




1 原子の構造と化学結合 元素 イオン結合と電子配置の関係を知ろう 大学受験化学 理論化学




元素周期表と原子の構造 電子配置や質量数 電子殻の概念 Hatsudy 総合学習サイト



2 1 価電子と化学結合 スペクトル色々




オクテット則 8電子則 大学化学講座
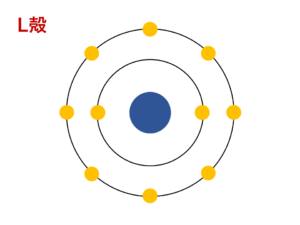



図解 電子配置の書き方の解説と電子配置の一覧 周期表 サイエンスストック 高校化学をアニメーションで理解する



配位結合 例 強さ 共有結合との違い 錯イオンとの関係など 化学のグルメ



半導体の電気的性質 P型半導体とn型半導体 Semiジャーナル
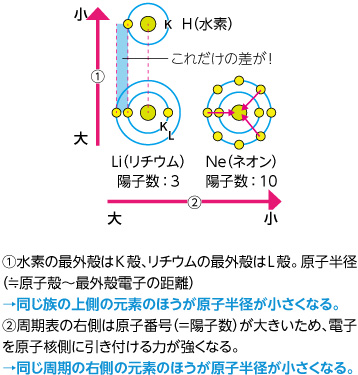



周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス



リンには価電子が3つしかないのにリン酸の構造を見ると価電子が5つあるように表 Yahoo 知恵袋




コンピューターやスマホなど現代文明に欠かせないトランジスタの原理がよくわかるムービー ライブドアニュース



リンはなぜ5本の価標 手 をのばせるんですか リンは最外殻電子数が5なの Yahoo 知恵袋



化学p リン が不対電子を3つもつのはなぜですか 非共有電子対2つに Yahoo 知恵袋




化学基礎 問題集 高校 第1編 物質の構成 05 2節 電子配置と周期表




リン酸の構造式についての質問です 電子式から考えると リン酸の構 化学 教えて Goo



Edu Chunichi Co Jp




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット
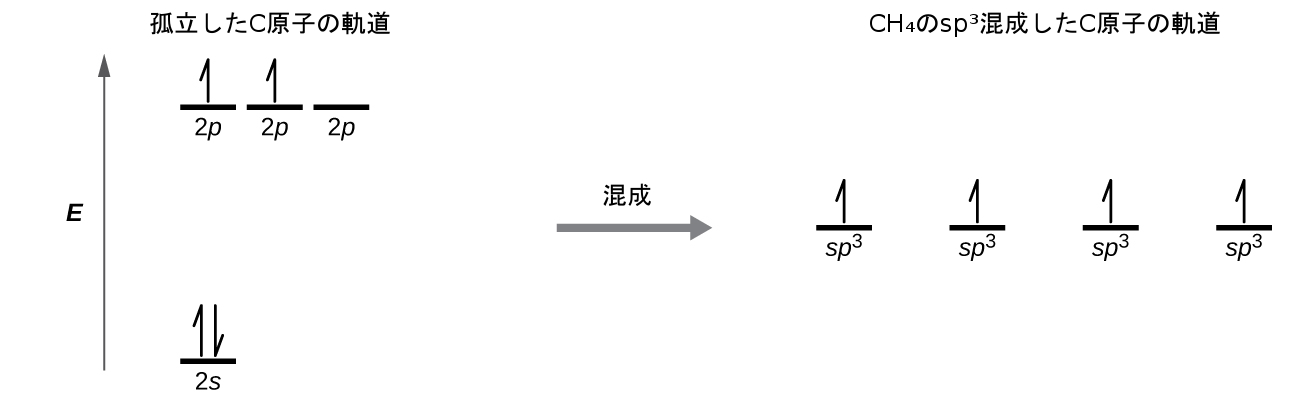



第8章 共有結合の高度な理論 化学 第2版




電子配置と価電子 だいたいわかる高校化学 基礎



半導体とは



かがくののおと




リン酸の化学式 分子式 構造式 イオン式 分子量は 価数や電離式は



ホウ素とリンの最外電子殻の種類 k殻 l殻とかいうやつです をお Yahoo 知恵袋
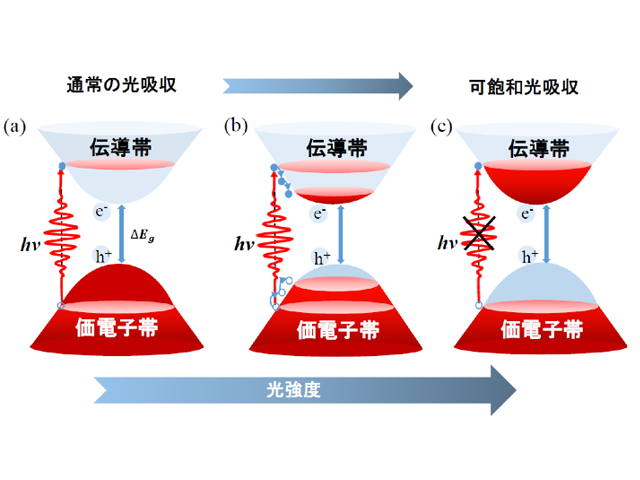



広島大ら 黒リンの電子のたたき上げを初めて観測 Optronics Online オプトロニクスオンライン
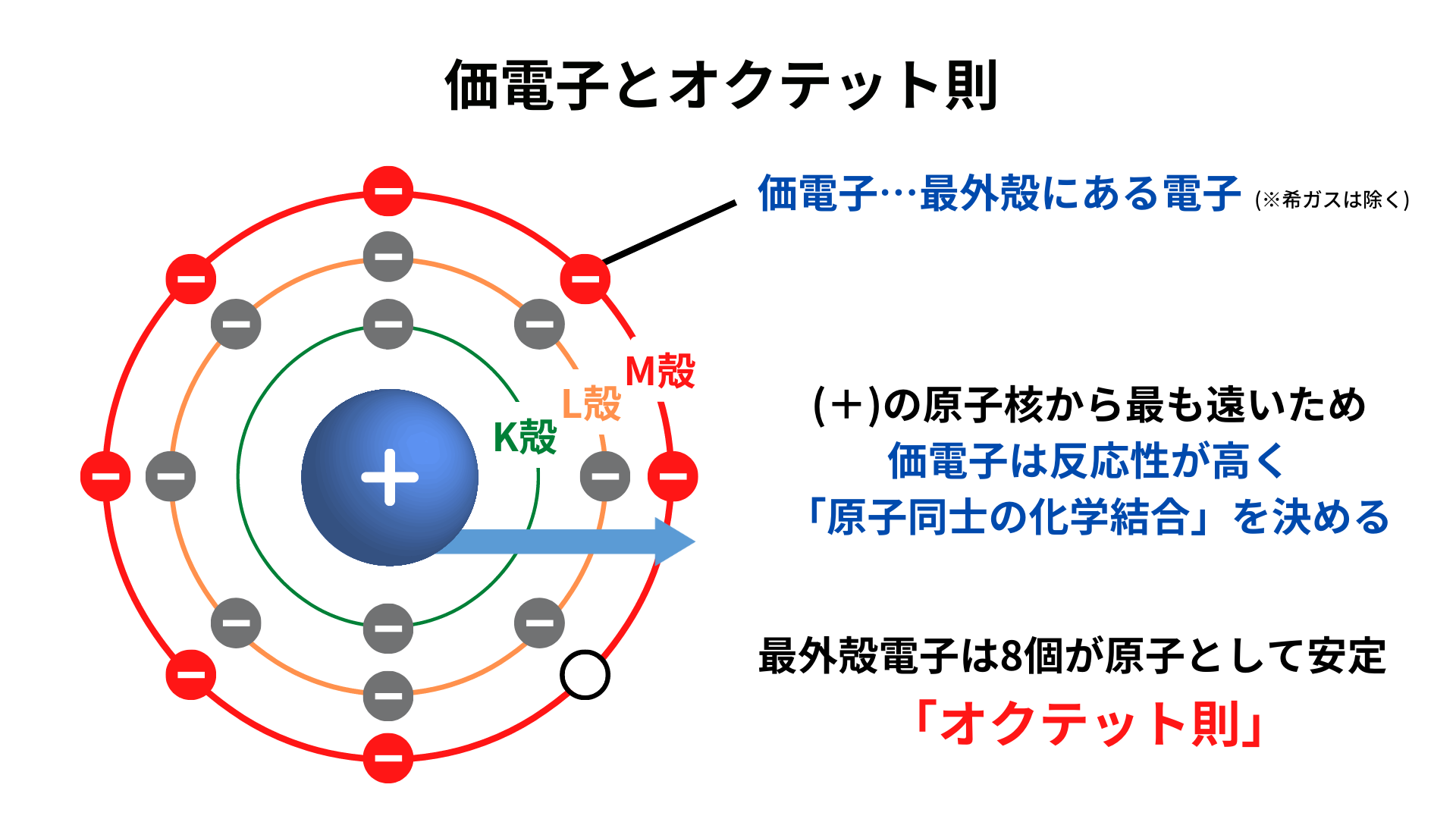



半導体の電気的性質 P型半導体とn型半導体 Semiジャーナル




有機リン化合物 Wikipedia
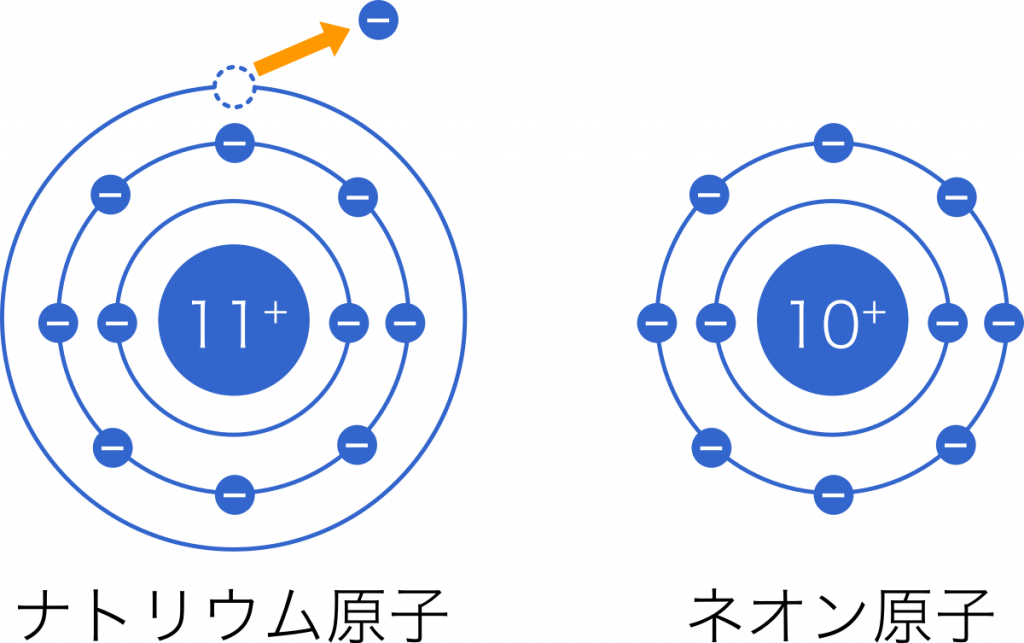



高校化学基礎まとめ イオン Mm参考書



2 1 価電子と化学結合 スペクトル色々
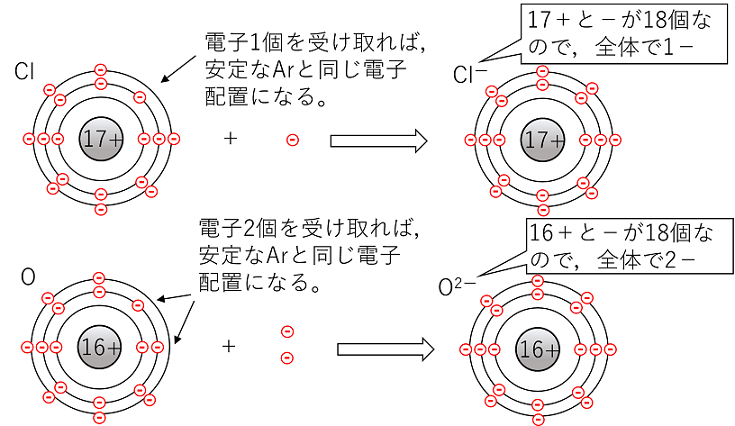



イオン



半導体の原理 制御工学の基礎あれこれ




オクテット則 8電子則 大学化学講座



リンには価電子が3つしかないのにリン酸の構造を見ると価電子が5つあるように表 Yahoo 知恵袋



Q Tbn And9gct 1smldz9laaa2tkfkizp5owqutqwbek Hcy0ktbfisdiobkn0bw14 Usqp Cau




電子式 書き方 ルール 一覧 演習問題など 化学のグルメ
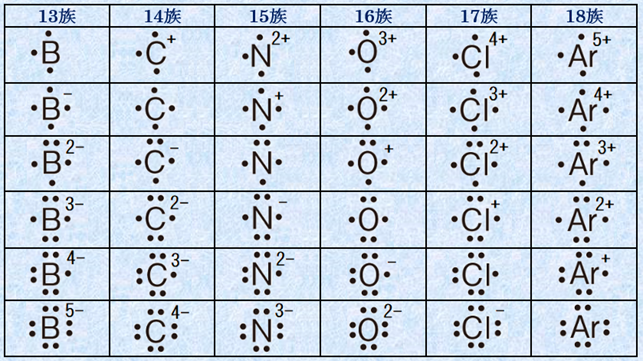



混成軌道
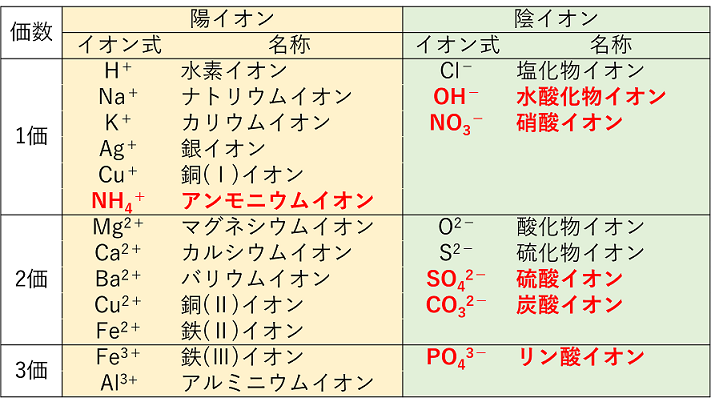



イオン



五塩化リンの電子式を教えてください Yahoo 知恵袋




N型半導体 Wikipedia



実習4 原子のイオン化 電子配置 3年理科 化学 Takaの授業記録18



Pt 白金 Au 金 Hg 水銀 は陽子が一個違うだけなのに その性質は異なります これを 例えば電子殻に配置される電子の数の組み合わせの妙として すっきり説明できたりしますか Quora
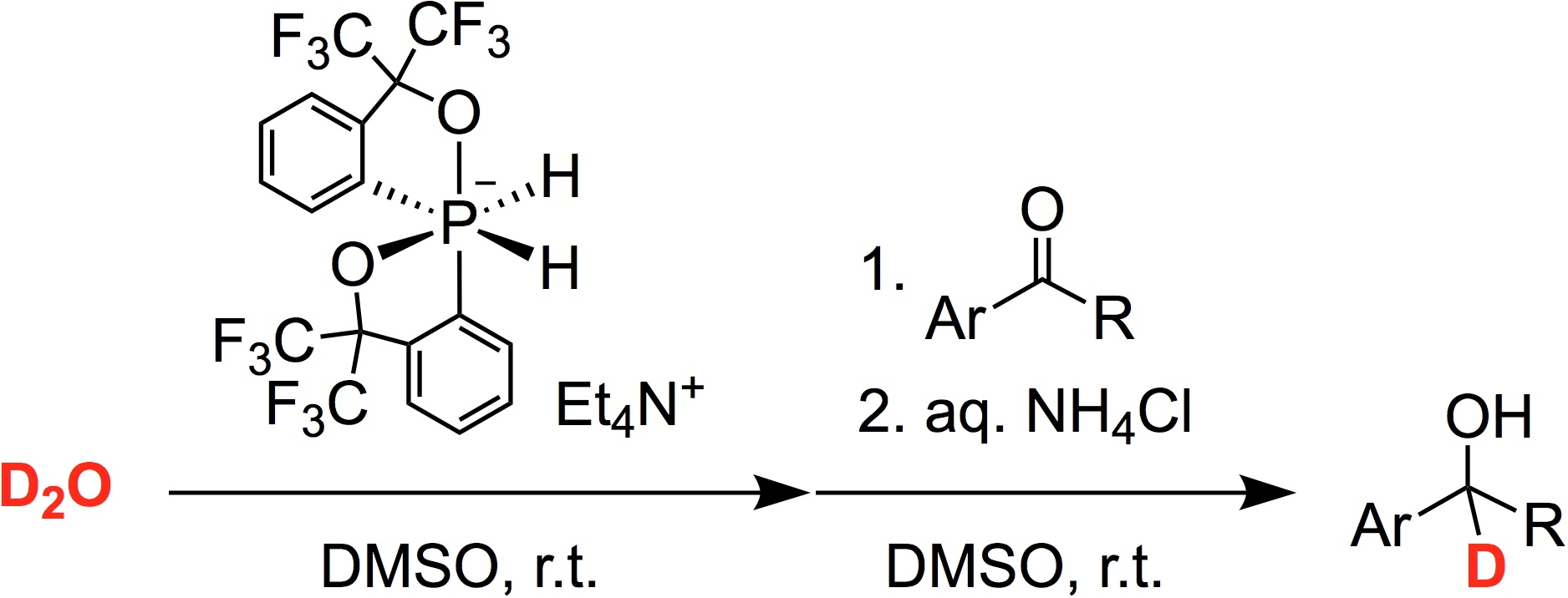



狩野研究室 学習院大学理学部化学科



化学 電子雲の重なり 技術情報館 Sekigin 最外殻電子の軌道が重なり共有結合を形成する 電子の軌道 即ち電子 雲の重なりの概念 混成軌道の概要を紹介




3分で簡単 オクテット則 価電子のルールを理系ライターがわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




リン酸の化学式 分子式 構造式 イオン式 分子量は 価数や電離式は




超原子価 Wikiwand



材料科学研究科 松村研究室
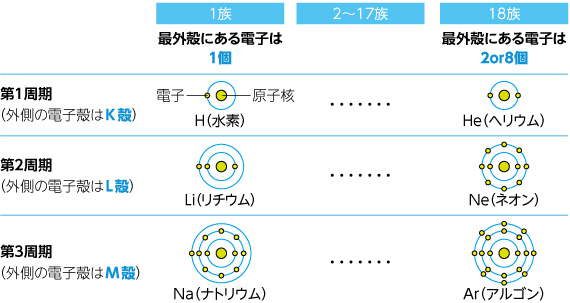



周期表バンザイ Icemsリサーチスコープ 京都大学アイセムス
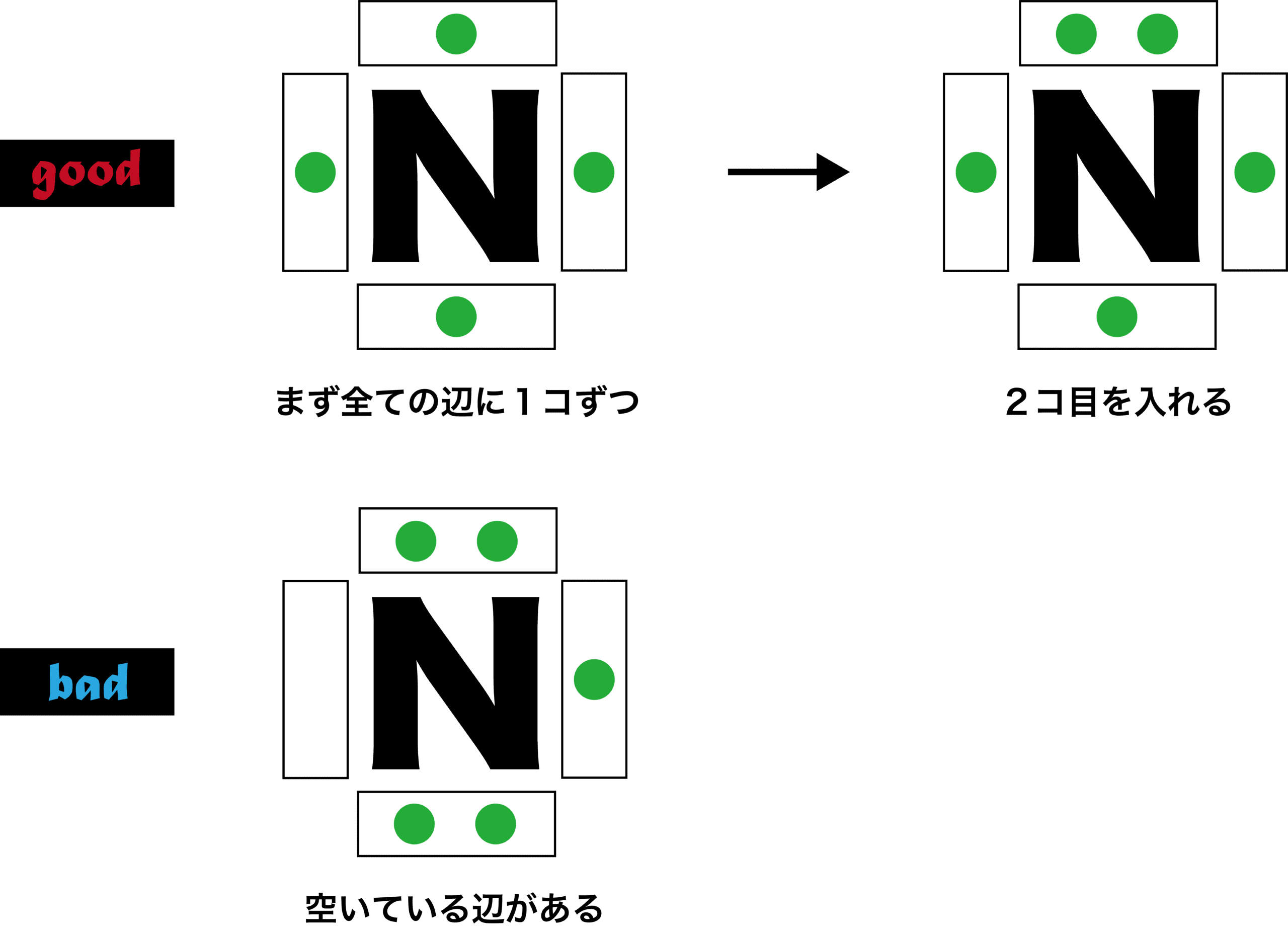



電子式 書き方 ルール 一覧 演習問題など 化学のグルメ
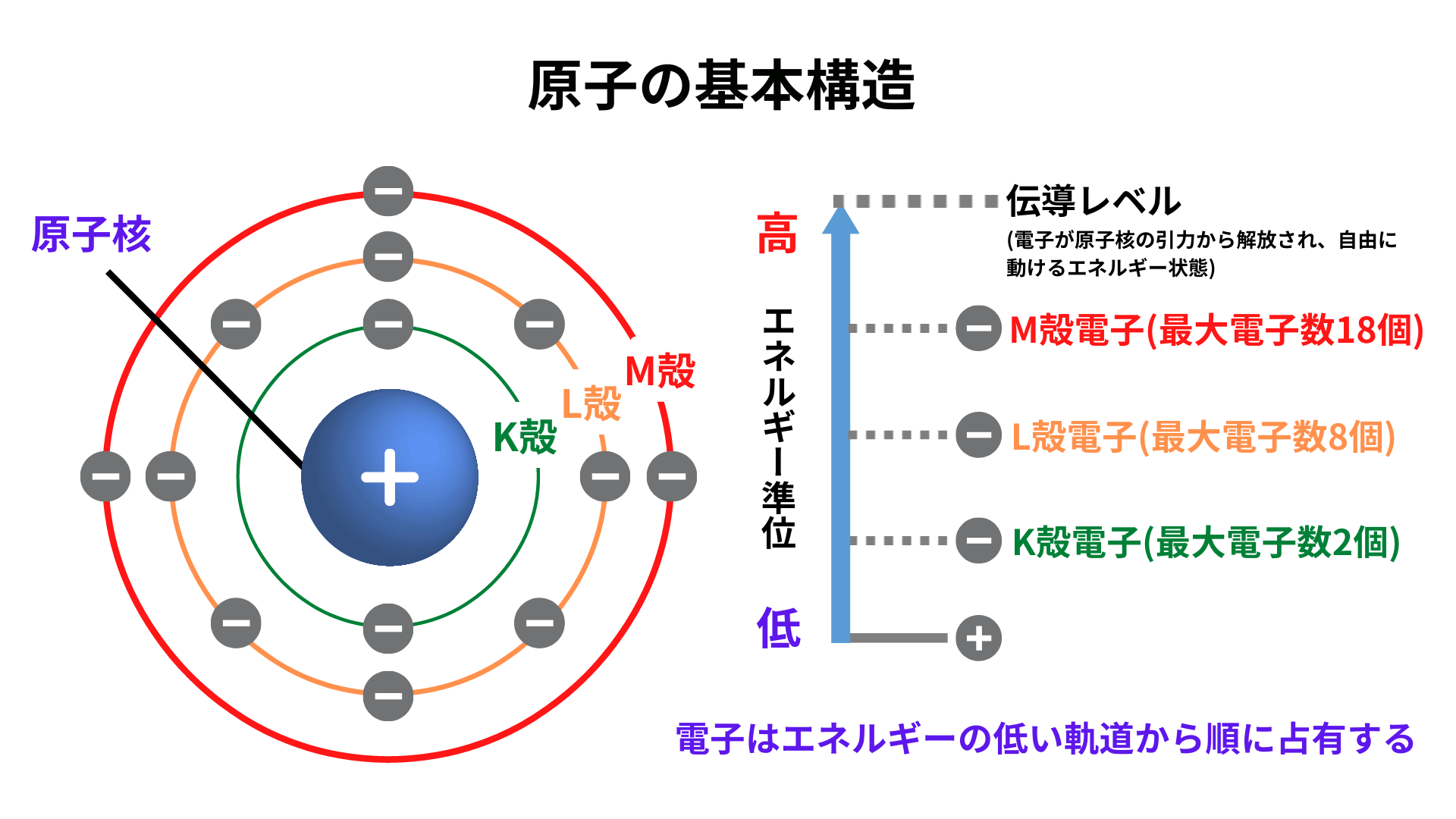



半導体の電気的性質 P型半導体とn型半導体 Semiジャーナル




有機リン化合物 Wikipedia



Q Tbn And9gcr3evxd4nfmhjtbzo6mnoszj6fy1knncb6a27hgxrgoczjd24lgw72o Usqp Cau



0 件のコメント:
コメントを投稿